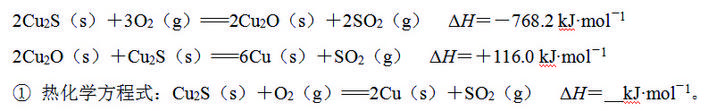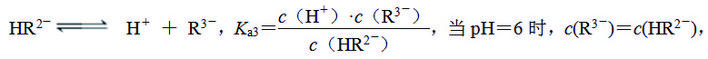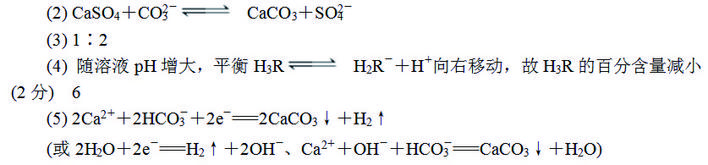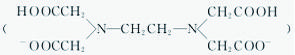□ 市实高 王荣
化学反应原理综合题是目前高考试题中必考题的最后一题,但它并不是最难题,化学试题的难度并不是逐级增加的,而是考查课程标准中要求达到的不同方面。本题仍以化工生产中的物质制备流程作为载体设计问题,和16、18、19题的工业流程并无明显区别,但其考查的侧重点各有不同。本题作为一道原理综合题,内容包括:盖斯定律、电化学、反应速率和平衡、电离平衡、水解平衡、溶解平衡、平衡常数表达式、氧化还原反应、沉淀转化、反应条件的选择等等。试题意在考查学生对化学反应原理的理解和掌握,并运用它解决化工生产中遇到的实际问题,意在引导中学化学对化工实践的衔接和指导作用。
【答案】
(1) ① -217.4 ② 阳 (2) ① H3PO2 ② 1 mol
(3) ① c(CuCl2)>c(CuCl+)>c(CuCl)② CuCl++Ag+===AgCl↓+Cu2+、CuCl2+Ag+===CuCl++AgCl↓或CuCl2+2Ag+===Cu2++2AgCl↓(4分)
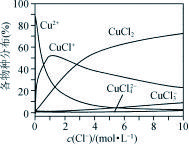
【解析】(1)①根据盖斯定律,将已知两个方程式相加后除以3得目标热化学方程式:Cu2S(s)+O2(g)===2Cu(s)+SO2(g) ΔH=-217.4 kJ· mol-1。粗铜精炼是电解原理的运用,只有粗铜做阳极时,纯铜做阴极才能提纯。(2)在反应中:4CuSO4+3H3PO2+6H2O===4CuH↓+4H2SO4+3H3PO4中,还原剂是化合价升高的物质,即H3PO2,该反应每转移3 mol电子,生成CuH的物质的量为1 mol。(3)氯化铜溶液中铜各物种的分布分数与Cl-浓度的关系如题图所示:当c(Cl-)=9 mol ·L-1时,过该点做垂线平行于纵轴,可得出大小关系。根据图像可以看出当c(Cl-)=1 mol ·L-1时,存在含有氯离子的物质有氯化铜和其阴、阳离子,据此写出方程式。
【例题】锅炉水垢既会降低燃料的利用率、影响锅炉的使用寿命,还可能造成安全隐患。某锅炉水垢的主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3,用酸洗法可除去该水垢,其基本原理如下:
【变式】H2Y2-是乙二胺四乙酸根 的简写,可与多种金属离子形成络合物。
Ⅰ. H2Y2-与Fe2+形成的络合物FeY2-可用于吸收烟气中的NO 。其吸收原理:
FeY2-(aq)+NO(g)FeY2-(NO) (aq) ΔH<0
将含NO的烟气以一定的流速通入起始温度为50 ℃的FeY2-溶液中。 NO吸收率随通入烟气的时间变化如图。时间越长,NO吸收率越低的原因是 。
(2) 生成的FeY2-(NO)(aq)可通过加入铁粉还原再生,其原理:FeY2-(NO)(aq)+Fe+H2O→FeY2-(aq)+Fe(OH)2+NH3(未配平)。若吸收液再生消耗14 g铁粉,则所吸收的烟气中含有NO的物质的量为 。
Ⅱ. 络合铜(CuY2-)废水的处理一直是环境工程领域的研究热点。
① 表中最不稳定的金属络合物是____(填化学式)。向含有络合铜(CuY2-)废水中加入一种黄色的盐溶液A可解离出Cu2+,则盐A中阳离子为____(填化学式)。
② 调节pH可将解离出的Cu2+转化为Cu(OH)2沉淀,若要使c(Cu2+)≤2.2×10-4 mol·L-1,pH应不低于________(常温下,Ksp[Cu(OH)2]=2.2×10-20)。
(2) 羟基自由基(·OH)、Na2FeO4都可氧化络合铜中的Y4-而使Cu2+得到解离。
① 酸性条件下,·OH可将Y4-(C10H12O8N24-)氧化生成CO2、H2O、N2。该反应的离子方程式为__________。
② Na2FeO4在酸性条件下不稳定。用Na2FeO4处理后的废水中Cu2+的浓度与pH的关系如图。 pH越大,废水处理效果越好,这是因为________________
____________________________。
(1) “酸洗”时,一般不选用稀硫酸的原因是 。
(2) “不溶物”用碳酸钠溶液浸泡的目的是 (用离子方程式表示)。
(3) 为防止洗出液中的Fe3+腐蚀铁质管道,常在洗出液中加入SnCl2溶液,反应中Sn2+转化为Sn4+,则Sn2+与Fe3+反应的物质的量之比为 。
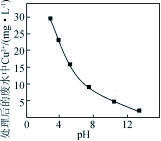
(4) 柠檬酸(用H3R表示)可用作酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图甲所示。图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是 (用平衡移动原理解释)。HR2-电离常数为Ka3,请根据图示信息计算出pKa3= (pKa3=-lgKa3)。
(5) 利用如图乙所示装置对锅炉水(含Ca2+、Mg2+、HCO3-)进行预处理,可有效防止锅炉水垢的形成。写出电解过程中,Ca2+形成沉淀的电极反应方程式: 。
【答案】
(1) 稀硫酸与碳酸钙反应会生成微溶物硫酸钙,覆盖在反应物表面,阻止反应进一步进行
【解析】(1)稀H2SO4与CaCO3反应生成微溶性的CaSO4,会阻止反应的进行。(2)CaSO4是微溶的,加入Na2CO3后会转化成更难溶的CaCO3,便于除去。(3)Fe3+氧化Sn2+生成Fe2+和Sn4+,根据得失电子守恒,确定关系为n(Sn2+)∶n(Fe3+)=1∶2。(4)酸性条件下,H3R最多,则曲线a表示H3R,随着碱性增强,H3R的浓度会变小,生成H2R-,即曲线b为H2R-。碱性继续增强,会依次生成HR2-和R3-,分别对应曲线c和d。HR2-的电离平衡为
此时Ka3=c(H+)=10-6,pKa3=6。(5)Ca2+与CO反应生成CaCO3沉淀,CO是由HCO 与OH-转化成得,故电解过程中需要产生OH-,则电极反应式为2Ca2++2HCO+2e-===2CaCO3↓+H2↑。
【答案】
Ⅰ. (1) 反应放热,温度升高,不利于NO的吸收;随着反应进行,FeY2-浓度降低
② 酸性越强,Na2FeO4越容易分解;pH越大,Cu2+更容易沉淀;Na2FeO4氧化Y4-,自身被还原成Fe3+,水解产生的Fe(OH)3胶体有絮凝作用,使Cu(OH)2更易沉降。
【解析】Ⅰ.(1)吸收原理为放热反应,随着反应的进行,温度升高,NO的溶解度降低;图像横坐标为反应时间,所以从反应速率的影响角度考虑,随着反应的进行,吸收液的浓度降低,导致NO的吸收率降低。(2)配平反应方程式得2FeY2-(NO)(aq)~5Fe,n(NO)=n(Fe)=0.1 mol。
Ⅱ. (1)①三个反应的平衡常数分别为1018.8、1025.1、1010.7,第三个反应的平衡常数最小,说明该平衡正向进行的程度较小,则最不稳定的是CaY2- ,FeY-最稳定,加入Fe3+,Fe3+与H2Y2-能够生成更稳定的络合物FeY-,导致第一个反应平衡左移,解离出Cu2+。②Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-)=2.2×10-20,c(OH-)≥10-8 mol·L-1,pH应不低于6。(2)①酸性条件下,·OH 可将Y4-(C10H12O8N24-)氧化生成CO2、H2O、N2,由得失电子守恒知该反应的离子方程式为40·OH+H12C10 N2O84-4H+===10CO2↑+N2↑+28H2O 。②酸性条件下Na2FeO4不稳定,容易分解,pH越大,Cu2+越容易生成沉淀,题给信息可知,Na2FeO4可氧化络合铜中的Y4-,FeO42-被还原为Fe3+能够形成胶体,胶体具有吸附性。
化学反应原理综合题,在历年高考考试说明中均界定为较难题,因为题中涉及的图像和图表太多,会给人一种无从下手的假象,对学生的应试心理是一种挑战。但当你真的沉下心来去看题,它考查的并不是一个复杂的系统问题,而是化学反应原理的不同角度、不同方面,涉及的知识并不复杂。即使是貌似复杂的图表,其实是传递了一种化工生产中的测量方法,而提出的问题常常比较简单。建议同学们在解题时,先看问题再看图表,这样获取的信息就更有针对性,不知不觉中,七个小题已经各个击破。
【练习】铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1) 由辉铜矿制取铜的反应过程如下:
② 获得的粗铜需电解精炼,精炼时粗铜作 极。
(2) 氢化亚铜是一种红色固体,可由下列反应制备:
4CuSO4+3H3PO2+6H2O===4CuH↓+4H2SO4+3H3PO4
① 该反应还原剂是 (填化学式)。
② 该反应每转移3 mol电子,生成CuH的物质的量为 。
(3) 氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-)的关系如下图所示。
① 当c(Cl-)=9 mol·L-1时,溶液中主要的3种含铜物种的浓度大小关系为 。
② 在c(Cl-)=1 mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为___________________(任写两个)。